El chile, que pertenece al género Capsicum, también conocido como ají, pimiento o guindilla, es originario del continente americano. Existen más de cuarenta variedades y dentro de ellas distintos niveles de picor. El picor del chile está determinado por la cantidad de capsaicina. La capsacicina y otros compuestos similares se conocen como “capsaicinoides” y se producen como metabolitos secundarios. Aunque en el chile se encuentran distintos tipos de capsaicinoides, la capsaicina es su principal compuesto químico; responsable de causar la sensación de calor y a veces de dolor al comerlo. Se cree que la planta del chile desarrolló la formación de este compuesto como protección ante depredadores. Históricamente, el chile se ha usado por su color, como pigmento; su rico sabor y su penetrante aroma Además, se sabe que la capsaicina tiene propiedades farmacológicas y se ha usado como analgésico para atenuar el dolor causado por la artritis y la inflamación.

Dentro de las distintas variedades de chile, se encuentras distintos niveles de picor. En 1912, el farmacólogo americano Wilbur Scoville (1865-1942) desarrolló la escala de Scoville para medir los niveles de picor que puede alcanzar el ají. Esta escala puramente empírica, se creó con base en la respuesta de un grupo de personas a distintas cantidades de capsaicinoides por el sentido del gusto. Es entonces que la escala de Scoville, oscila entre el 0 unidades de calor scoville siendo “no picante” y los 16 millones de unidades de calor scoville (SHU-por sus siglas en inglés-), donde se ubica la capsaicina pura. Un chile habanero se ubica entre las 300 000 SHU.
¿Sabe usted cómo es que respondemos a las distintas unidades de picor? ¿Qué parte de nuestro sistema es el que nos manda la señal que nos hace decir: Uf esto pica!?
En el sistema nervioso hay distintos tipos de células especializadas, mejor conocidas como neuronas. Las neuronas sensoriales o aferentes responden a distintos estímulos físicos como lo son el calor, el frío o la presión, por ejemplo cuando alguien nos empuja o nos pellizca. Así mismo las neuronas sensoriales responden a estímulos químicos, como irritantes o ácidos, por ejemplo cuando nos cae limón en la herida. Existe un subgrupo de neuronas sensoriales que transmiten información relacionada a lesiones en tejido, ya sea mecánica, física o química, esto como señal de alarma. Dichas neuronas además envían esta información a centros especializados en el cerebro y médula espinal, que inducen una respuesta en forma de dolor.
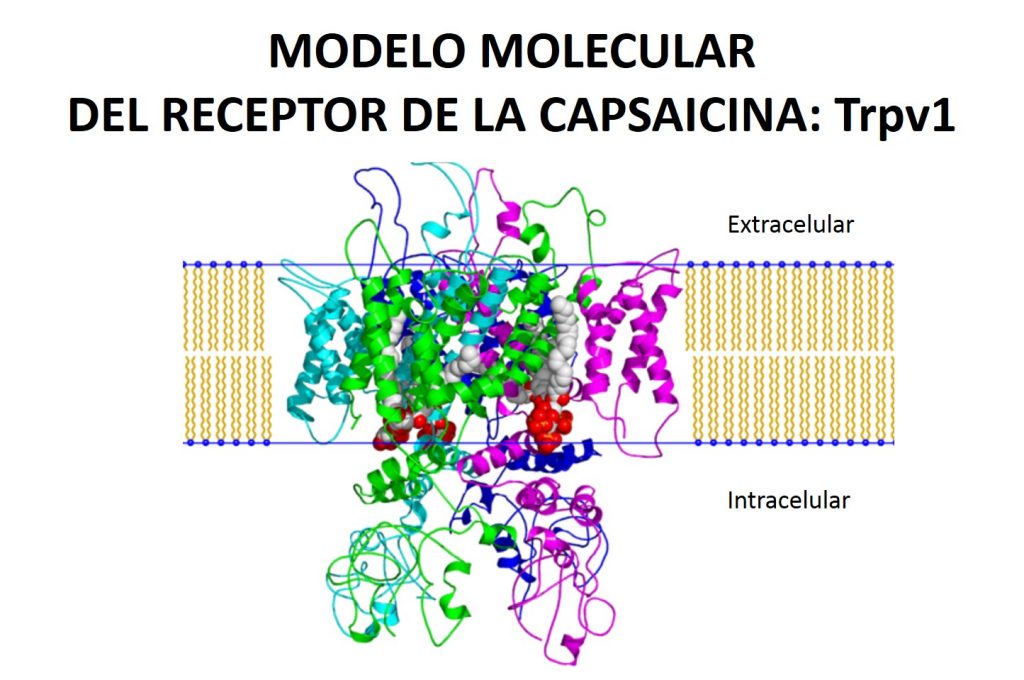
La capsaicina actúa en el cerebro como un estímulo químico activando a las neuronas sensoriales y creando como respuesta una reacción inflamatoria y la sensación de dolor. Esto se debe a que las neuronas sensoriales cuentan con receptores que son específicos para recibir los estímulos antes mencionados. Y es que resulta que los receptores los cuáles son proteínas se han clasificado en distintos grupos y es una familia de receptores en particular, la que se activa en presencia de la capsaicina, por ejemplo cuando comemos un chile picoso. Además del picante, temperaturas mayores a 43°C y niveles de acidez o pH menores a 6 –sustancias ácidas- también activan este tipo de recpetores. Estos receptores pertenecen a la familia del receptor de potencial transitorio (TRP) y más específicamente el de potencial transitorio vanilloid 1 o TRPV1, el cual es muy importante, ya que sin él no tendríasmos ninguna señal de alarma frente a estímulos peligrosos como lo son las altas temperaturas, las sustancias ácidas o un chile muy picoso.
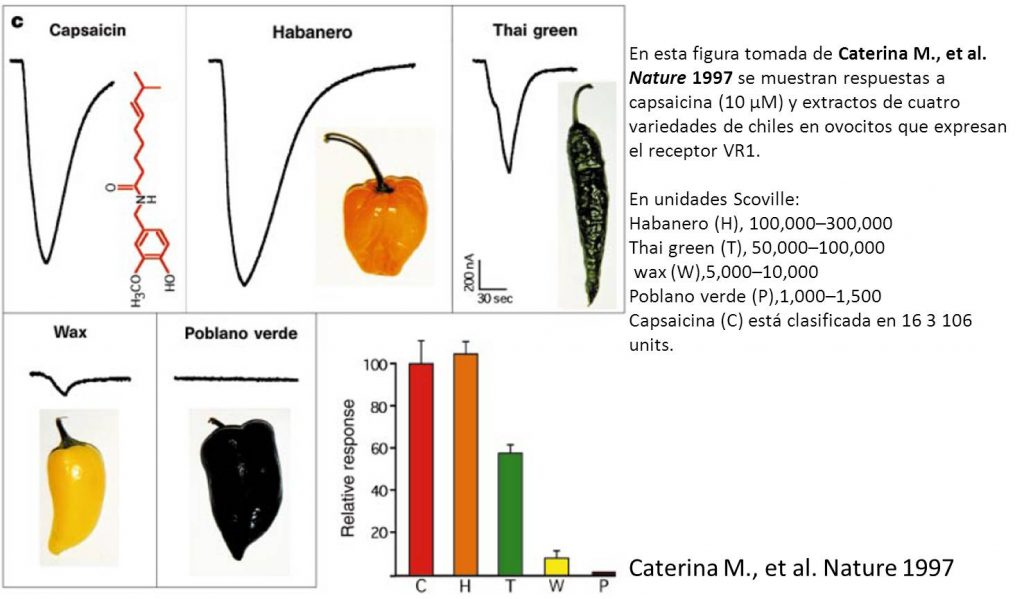
Los electrofisiólogos –especialistas en medir las actividades eléctricas que presentan las neuronas– han desarrollado métodos para medir la activación de receptores. Es entonces posible medir respuestas inducidas a partir de distintos estímulos, como lo puede ser la capsaicina. En 1997, Caterina MJ y colaboradores, midieron la respuesta eléctrica generada por receptores en presencia de extractos de chile. Pesaron una una cantidad específica de capsaicina (10 μM), lo que sería más o menos equivalente a 16 millones de unidades en la escala de Scoville) y evaluaron su respuesta eléctrica. También midieron las respuesta eléctrica en presencia de extractos de otras 4 variedades de chiles: entre los cuales se encuentran el habanero y el poblano verde. La gráfica que ilustra los resultados del experimento (figura 3), donde se puede observar que distintos niveles de picor inducen distintas respuestas eléctricas, representa un método experimental y reproducible para evaluar la respuesta fisiólógica a la capsaicina, así mismo en este estudio se confirma que el receptor que responde a calor es el mismo que responde a la capsaicina y conecta desde el punto de vista molecular, la relación entre la sensación de calor y al ingerir chile picante.
Por otro lado, y como dijimos antes, el chile tiene propiedades analgésicas, es decir que calma el dolor. Èsto se debe a la desensibilización de receptores por su estimulación prolongada. La desensibilización de receptores es un fenómeno que ocurre cuando se estimulan las terminales nerviosas por periódos prolongados. Es decir que si se aplica capsaicina por periódos largos o si se come mucho, eventualmente se pierde sensibilidad y entonces la respuesta es menor, digamos que “se hace callo” al chile. Y es por esto que la capsaicina, se puede usar para el tratamiento del dolor causado por enfermedades como lo es la artritis reumatoide.
El receptor TRPV1 en especies no-humanas

En las aves, el receptor TRPV1 no responde a la capsaicina, aunque sí a sustancias ácidas y al calor. En la mayoría de los vertebrados, el receptor responde a los estímulos físicos y químicos mencionados anteriormente. Sin embargo, hay un mamífero cuyas neuronas sensoriales no responden ni a la capsaicina ni a sustancias ácidas. Es decir que a ellos el chile ni les viene ni les va. Se trata de la rata topo desnuda (Heterocephalus glaber) la cual habita principalmente en Etiopía, Kenia y Somalia. Esta rata es subterránea y ciega, se le llama desnuda por la falta de pelo. Este mamífero es particularmente interesantes porque posee caracterísicas distintas de las de la mayoría de los mamíferos. Una de estas características, es el tipo de organización social que mantienen, conocida como “eusocial”; es similar a la de las hormigas y las abejas, donde sólo hay una hembra reproductiva: es la reina en cada colonia, el resto de los integrantes son estériles. Otra característica es su insensibilidad a los estímulos de la capsaicina. Es decir, no sufren dolor ante su ingestión. Pero no es porque no tengan el receptor TRPV1 y tampoco es que este receptor no se active en la presencia de la capsaicina, de hecho sí lo hace.
Pero entonces, ¿por qué la rata topo no siente dolor cuando es expuesta a la capsaicina? Pues no queda muy claro, pero al parecer, las neuronas sensoriales en estas ratas no logran transmitir la señal a los centros del dolor, ubicados en la médula espinal y como consecuencia no se activan los circuitos que normalmente lo producen. Además, la rata topo desnuda se ha convertido en un modelo biológico para el campo de investigación del dolor. Y es que entender cómo es que se produce y cómo se puede controlar el dolor es esencial para una mejor calidad de vida en el caso de ciertas enfermedades como la artritis reumatoide, por mencionar alguna.
Pero la rata topo no es el único modelo utilizado para entender los mecanismos moleculares del dolor. Recientemente –en noviembre de 2014- se publicó un estudio muy interesante del grupo de la investigadora Kristin Baldwin, en el cual se discute una nueva forma para estudiar los mecanismos moleculares del dolor. Esta investigación, desarrollada en el Instituto de Investigación Scripps en La Jolla, California, Estados Unidos presenta por primera vez un método para transformar fibroblastos humanos –células del tejido conectivo como las células de la piel- en neuronas sensoriales especializadas. Esto de convertir células humanas especializadas de un tipo en otras ya se ha hecho antes, y es un fenómeno que se conoce como reprogramación celular, pero esta es la primera vez que reprograman fibroblastos en neuronas preriféricas sensoriales. Las neuronas periféricas sensoriales que describe el artículo son un parteaguas para el desarrollo de nuevos medicamentos eficaces en el tratamiento del dolor. Este modelo permitirá desarrollar nuevas investigaciones, que muy probablemente nos ayudarán a entender mejor cómo es que se produce el dolor, cómo se regula y cómo se pueden desarrollar nuevos tratamientos para éste.
La idea detrás de este tipo de desarrollos biológicos, es dirigir la medicina hacia la medicina personalizada. La medicina personalizada tiene como objetivo curar de manera más específica a cada individuo, es decir que en vez de dar el mismo tratamiento a todos, se trata de dar un tratamiento individual. Y es que sí, todos somos humanos pero no todos respondemos igual a un tratamiento. Supongamos que tú padeces de una enfermedad que te causa mucho dolor, y resulta que existe una gran paleta de analgésicos pero saber cuál es el indicado para ti puede llevar meses. Lo que este estudio presenta es la posibilidad, de que se tome una muestra de células vivas de tu piel, que se reprogramen esas células que son tuyas, en receptores sensoriales y que se haga de manera sistemática y mecánica una prueba farmacológica para identificar cuál es el mejor tratamiento para ti. ¿Suena bien no? Bueno, pues hacia allá va esto.
Artículos citados:
Blanchard J. et. al. (2014) Selective conversion of fibroblasts into peripheral sensory neurons. Nature Neuroscience.
Michael J. Caterina et al. (1997). The capsaicin receptor: a heat-activated ion channel in the pain pathway. Nature.





Sin comentarios