Iván Alquisiras Burgos y Penélope Aguilera
Resumen
La administración de fármacos utilizando nanoacarreadores que protegen y facilitan su transporte de manera eficiente hasta el cerebro, es un avance tecnológico comparable con la carrera espacial.
Los nanomateriales usados en el viaje fantástico en el cuerpo humano
Desde que el ser humano levantó la vista hacia el cielo, ha soñado con viajar al espacio. Convertir ese anhelo en realidad implicó superar obstáculos que parecían insalvables. Para abandonar la Tierra, las naves deben alcanzar la velocidad de escape —más de 40,000 km/h— y seguir trayectorias calculadas con absoluta precisión. El regreso no es menos complejo: la atmósfera, que funciona como una barrera protectora del planeta, representa un reto importante. La fricción de las naves al entrar en contacto con ella, genera temperaturas capaces de fundir metales, lo que obliga a diseñar sistemas de protección térmica y ángulos de entrada exactos para evitar su destrucción. A esto se suman la radiación solar, los impactos de partículas cósmicas y los riesgos de un aterrizaje seguro. Cada etapa de la travesía espacial ha sido una prueba de ingenio y resistencia humana.
Pero el viaje hacia las estrellas, no es el único que ha representado un gran reto, también como lo imaginó Isaac Asimov, el viaje en el cuerpo humano y hacia el cerebro es complejo. Administrar fármacos que se dirijan hacia un órgano blanco, ya supone un desafío: muchas moléculas carecen de especificidad para dirigirse exclusivamente a un órgano en particular; incluso antes de entrar en contacto con las barreras propias de cada uno, serán metabolizadas rápidamente en el hígado o atrapadas en su trayecto por los guardianes en la sangre (el sistema inmunológico). Para superar estos obstáculos, la ciencia ha diseñado sistemas capaces de proteger a los fármacos y facilitar su tránsito a través de las distintas barreras naturales.
Pero ninguna de esas barreras resulta tan estricta como la hematoencefálica, la que protege al cerebro. A diferencia de lo que suele pensarse, no es una envoltura que cubre su superficie, sino una red de vasos sanguíneos con propiedades únicas, que sirven para controlar el paso de sustancias desde la sangre hacia el parénquima cerebral. Los espacios entre las células que forman estos vasos, llamadas endotelio vascular, están sellados proteínas de adhesión que unen las membranas celulares impidiendo el paso de moléculas mayores a 1 nm (1 cm equivale a 10 millones de nanómetros). Además, en su superficie despliegan una batería de transportadores que controlan con rigidez qué sustancias pueden entrar hacia el parénquima cerebral y cuales no. Entre ellos, los transportadores ABC actúan como guardianes incansables, que expulsan aquellas moléculas que lograron infiltrarse —en especial lipofílicas— y que podrían alterar el equilibrio del sistema nervioso.
Así, el ingreso de fármacos al cerebro solo es posible a través de rutas altamente especializadas, lo que convierte a la barrera hematoencefálica en uno de los mayores desafíos de la medicina moderna. Al igual que la carrera espacial del siglo XX llevó a la humanidad a conquistar la Luna, hoy la biomedicina libra su propia batalla: encontrar la manera de llevar terapias seguras y eficaces al órgano más protegido y complejo de todos, el cerebro.
Los diversos prototipos de un nano transbordador al cerebro
Así como un transbordador espacial requiere un diseño específico para resistir la atmósfera, navegar en el vacío, aterrizar de forma segura y entregar en algunos casos su valiosa carga, los nanomateriales se han convertido en las naves que transportan fármacos al interior del cerebro. Estas estructuras, cuyo tamaño oscila entre 2 y 1000 nanómetros, actúan como vehículos especializados que deben proteger su carga, sortear obstáculos y aterrizar en los lugares correctos. Pueden clasificarse dependiendo de su arquitectura, la cual es muy variable, en liposomas, micelas, nanopartículas poliméricas, nanogeles, nanocápsulas, entre otros. Tienen la capacidad de proteger a su “carga” de la degradación, aumentar la biodisponibilidad (manteniendo su concentración por mayor tiempo en el torrente sanguíneo), liberar el fármaco de manera constante y diversificar la vía de administración. En el caso de fármacos dirigidos al cerebro se puede utilizar estrategias invasivas como la intratecal (el canal central de la médula espinal) y no invasivas como la pulmonar y la nasal.
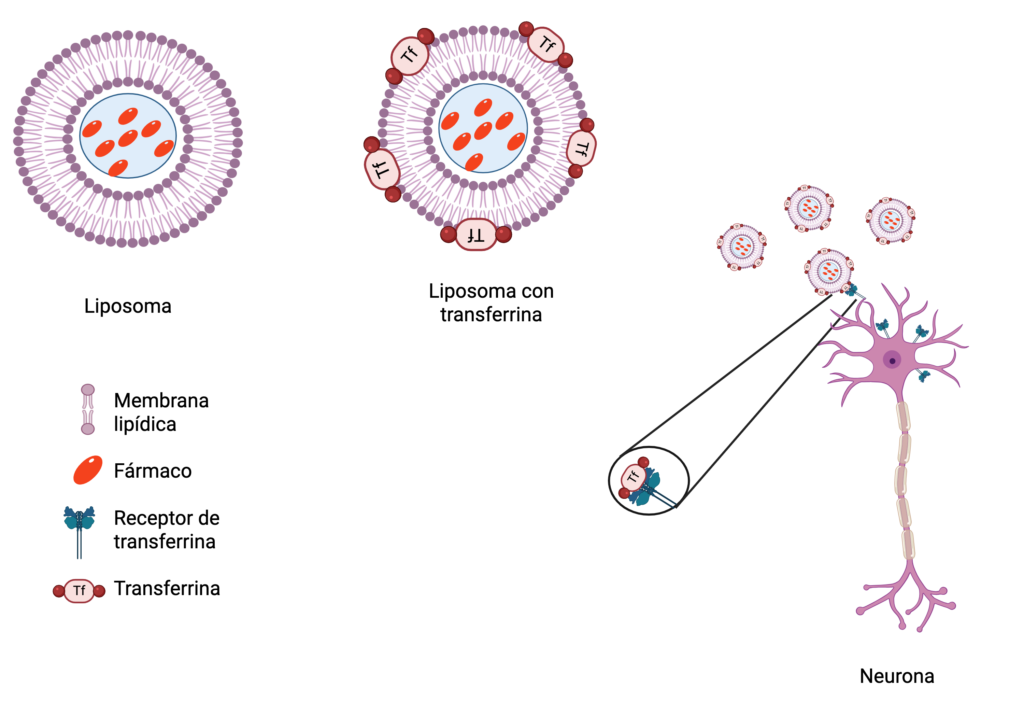
Los liposomas fueron el primer prototipo de estas naves terapéuticas desde su descubrimiento en 1965. Estos nanoacarreadores son como cápsulas con doble escudo (formado por una o varias capas lipídicas) que protegen a la carga y, al mismo tiempo, ofrecen un espacio interior acuoso, adaptable para distintos tipos de moléculas, tanto hidrofílicas como hidrofóbicas. La eficacia del viaje de estas nanonaves hacia el cerebro se incrementó al modificar su superficie con ligandos específicos como polímeros, péptidos, anticuerpos o aptámeros. Estos funcionan como sistemas de acoplamiento que les permiten atracar y unirse específicamente a proteínas exclusivas del tejido cerebral.
Un de los modelos más reconocidos, aunque aún no es específico de cerebro, son los liposomas funcionalizados con aptámeros de transferrina (una glicoproteína que se encarga de transportar hierro desde la sangre a todos los tejidos); estos liposomas son dirigidos hacia las células que contienen en su membrana el receptor de transferrina. En un estudio pionero, Lauritzen describió con detalle el “plan de vuelo” de los liposomas decorados con transferrina. Sus resultados demostraron que la transcitosis —un mecanismo celular utilizado para transportar moléculas atrapándolas en el interior de vesículas— permite que estas nanonaves crucen la barrera hematoencefálica y se internalicen en el cerebro. Dicho de otra manera, la transferrina actúa como un pase de abordaje molecular que facilita la entrada del liposoma a un territorio extremadamente protegido.
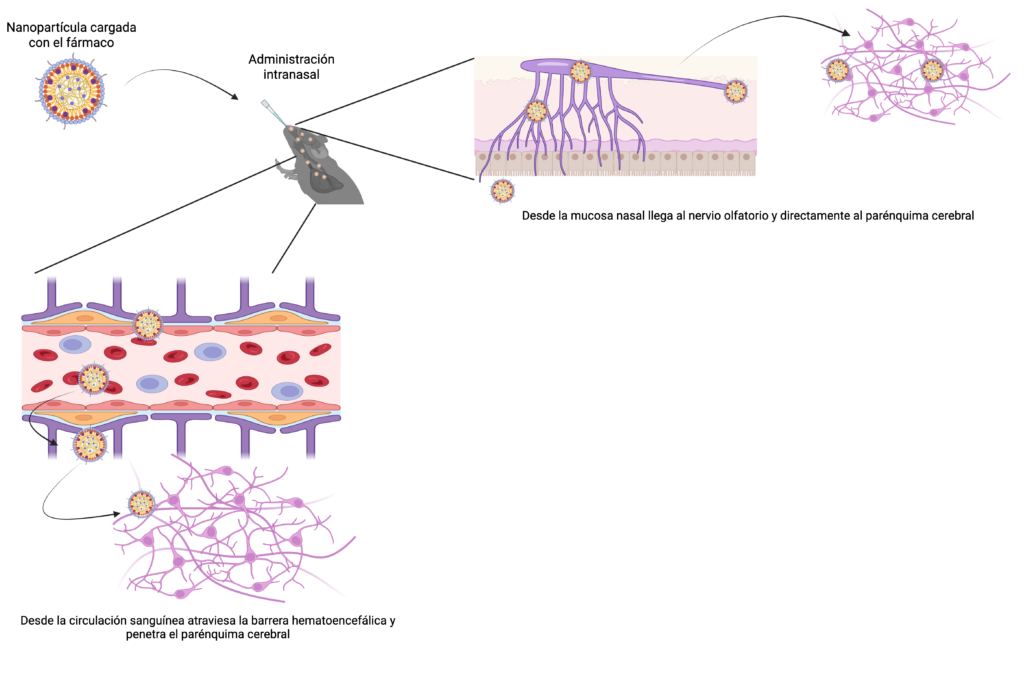
Entre los nuevos diseños de naves, destacan modelos más versátiles como las nanocápsulas (tamaño entre 100 y 500 nm) que tienen un fármaco inmerso en un núcleo (de tamaño variable) rodeado por una membrana polimérica de diferente espesor y permeabilidad. Entre estas se encuentran las nanopartículas inorgánicas (2 a 100 nanómetros) que funcionan como cargueros espaciales con poros y que utilizan materiales como el carbono, oro, plata, níquel y sílice. Son bodegas ideales para almacenar fármacos y su superficie puede decorarse con ligandos que actúan como un GPS molecular, asegurando que el cargamento llegue exactamente al lugar deseado.
Por ejemplo, las nanopartículas de oro son estructuras estables e inertes, capaces de navegar sin ser detectadas por los radares del sistema inmune. Su tamaño determina su éxito: las más pequeñas, menores a 10 nanómetros, pueden cruzar exclusivamente los cerebros sanos, mientras que las de hasta 100 nanómetros también penetran en cerebros dañados por infartos, tumores o epilepsia, ya que presentan fisuras en la barrera hematoencefálica. Además, estas cápsulas doradas pueden ser rastreadas mediante tomografía computarizada, como si tuvieran un sistema de localización incorporado. De manera similar, las nanopartículas de óxido de hierro tienen propiedades magnéticas que permiten guiarlas y controlarlas a distancia, como naves con propulsión magnética que se dirigen hacia el sitio correcto dentro del cerebro. Otro ejemplo interesante, son las nanopartículas de carbono, las cuales forman nanotubos de grafeno, un material muy delgado, con el grosor de un solo átomo de carbono, pero muy duro, más que el acero; además, flexible y ligero, por lo que son naves pequeñas, veloces, estables y resistentes capaces de atravesar la barrera cerebral mediante difusión pasiva.
Por otro lado, existen naves más sofisticadas denominadas biomiméticas, y que fueron diseñadas para camuflarse. Estas partículas se recubren con membranas de células reales, como las de los eritrocitos o neutrófilos, lo que les permite pasar desapercibidas por el sistema inmunológico y navegar con gran precisión hacia sitios de inflamación o daño cerebral. También existen naves “vivientes”, es decir, células circulantes como glóbulos rojos, plaquetas o células madre, que funcionan como cápsulas naturales para transportar fármacos. Estas son biodegradables pero resistentes, con capacidad para mantener sus cargas por largos periodos, aunque el desafío es evitar que se rompan en el camino y liberen prematuramente su contenido.
Estos ejemplos, nos remarcan que al igual que en la exploración espacial, el diseño de nanonaves que viajen por la circulación sanguínea requiere creatividad, precisión y pruebas constantes. Porque cada patología cerebral precisa de un fármaco cuyas propiedades fisicoquímicas representan un nuevo reto tecnológico, y por lo tanto, requiere de un transporte especial que la dirija al cerebro en el momento y a la concentración adecuada. Como cada tipo de nanopartícula tiene sus ventajas y limitaciones, el uso de nanomateriales tiene un enorme potencial para superar barreras biológicas y llevar terapias directamente al cerebro. Es así, que el trabajo conjunto entre investigadores de nanomateriales y biomédicos librarán las barreras de un viaje fantástico.
Bibliografía
Yu H, Yang Z, Li F, Xu L, Sun Y. Cell-mediated targeting drugs delivery systems. Drug Deliv. 2020 Dec;27(1):1425-1437. doi: 10.1080/10717544.2020.1831103. PMID: 33096949; PMCID: PMC7594730.
Han, L., & Jiang, C. (2021). Evolution of blood-brain barrier in brain diseases and related systemic nanoscale brain-targeting drug delivery strategies. Acta pharmaceutica Sinica. B, 11(8), 2306–2325. https://doi.org/10.1016/j.apsb.2020.11.023
Wu, D., Chen, Q., Chen, X., Han, F., Chen, Z., & Wang, Y. (2023). The blood-brain barrier: structure, regulation, and drug delivery. Signal transduction and targeted therapy, 8(1), 217. https://doi.org/10.1038/s41392-023-01481-w






Sin comentarios